جزوه آموزشی Aspen Polymerدانلود در ادامه مطلب


جزوه آموزشی Aspen Polymerدانلود در ادامه مطلب


برای دانلود رایگان کتاب آنالیز شیمیایی (Spectrochemical Analysis) تالیف اینگل (James D. Ingle و Stanley R. Crouch) که یکی از مشهورترین و معتبرترین منابع شیمی تجزیه می باشد؛ به ادامه مطلب بروید.
نام کتاب : Spectrochemical Analysis
نویسندگان : James D. Ingle و Stanley R. Crouch
انتشارات : Prentice Hall
چاپ : اول (March 21, 1988)
تعداد صفحه : ۶۰۸ صفحه
نوع فایل : PDF
حجم فایل : ۶۵٫۹۲ مگابایت
رمز عبور : ندارد
منبع : ۴shared

Cloud point extraction for high-performance liquid chromatographic speciation
of Cr(III) and Cr(VI) in aqueous solutions
Journal of Chromatography A, Volume 1036, Issue 2, 21 May 2004, Pages 183-188
*An-Na Tang, Dong-Qing Jiang, Yan Jiang, Shan-Wei Wang, Xiu-Ping Yan
Abstract:
Cloud point extraction (CPE) was applied as a preconcentration step for HPLC speciation of chromium in aqueous solutions. Simultanous preconcentration of Cr(III) and Cr(VI) in aqueous solutions was achieved by CPE with diethyldithiocarbamate (DDTC) as the chelating agent and Triton X-114 as the extractant. Baseline separation of the DDTC chelates of Cr(III) and Cr(VI) was realized on a RP-C18 column with the use of a mixture of methanol–water–acetonitrile (65:21:14, v/v) buffered with 0.05 M NaAc–HAc solution (pH 3.6) as the mobile phase at a flow rate of 1.0 ml min−۱. The precision (R.S.D.) for eight replicate injections of a mixture of 100 μg l−۱ of Cr(III) and Cr(VI) were 0.6 and 0.5% for the retention time, 4.1 and 4.6% for the peak area measurement, respectively. The concentration factor, which is defined as the concentration ratio of the analyte in the final diluted surfactant-rich extract ready for HPLC separation and in the initial solution, was 65 for Cr(III) and 19 for Cr(VI). The linear concentration range was from 50 to 1000 μg l−۱ for Cr(III) and 50–۲۰۰۰ μg l−۱ for Cr(VI). The detection limits of Cr(III) and Cr(VI) were 3.4 and 5.2 μg l−۱, respectively. The developed method was applied to the speciation of Cr(III) and Cr(VI) in snow water, river water, seawater and wastewater samples.
نام مقاله :
فرمت فایل : PDF
حجم فایل : ۱۰۹ کیلوبایت
تعداد صفحه : ۹ صفحه
برای دانلود مقاله و مطالعه متن کامل آن بر روی لینک زیر کلیک کنید.
عنوان مقاله : فلزات سنگین
قالب بندی : word, PDF
قیمت : رایگان
شرح مختصر : تعداد ۳۲ نمونه غذا ، آب منابع و عضله ماهی به منظور اندازه گیری فلزات سرب و آهن در فصلهای تابستان و پاییز ، در دو نوبت با فاصله ۳ ماه از چهار مزرعه پرورش ماهی قزل آلای رنگین کمان در استان چهارمحال بختیاری اخذ شده و مورد بررسی قرار گرفت . میزان آهن و سرب به ترتیب در کل نمونههای آب مزارع مختلف برابر با ۴/۴ ± ۶/۶۰ و ۲/۰ ± ۵/۲ میکروگرم بر لیتر ، میزان آهن و سرب به ترتیب در کل نمونههای خوراک مصرفی مزارع مختلف برابر با۸/۱۸۳ ± ۴/۵۶۳ و۱/۱ ± ۳/۳ میلیگرم بر کیلوگرم و همچنین میزان این دو فلز به ترتیب در کل نمونههای ماهی مزارع مختلف برابر با ۹/۳ ± ۷/۸ و ۱/۰ ± ۳/۰ میلیگرم بر کیلوگرم بوده است . با توجه به مقادیر بدست آمده از دو فلز فوق هیچگونه تفاوت معنیداری در سطح (۰۵/۰ p <) بین خوراک، ماهیان و آبهای مختلف مشاهده نشد ولی در کل ارتباط منطقی بین میزان این دو فلز در غذا و ماهیان تغذیه شده از همان غذا مشاهده گردید بطوریکه بیشترین میزان تجمع فلزات سنگین یاد شده در غذای کارخانه شماره ۲ و همینطور ماهیان تغذیه شده از این غذا و کمترین میزان تجمع این فلزات در غذای کارخانه شماره ۳ و ماهیان تغذیه شده با این خوراک مشاهده شد . با توجه به استاندارد های FAO برای فلزات سنگین و مقایسه آن با مقادیر بدست آمده در تحقیق حاضر، میزان این فلزات در آب، غذا و عضلات ماهی از حداکثر مجاز پیشنهادی کمتر میباشد. لذا هیچگونه خطری از جانب این منابع متوجه مصرفکنندگان بعدی مثل انسان نیست .
سرفصل :
بیان مسئله
اهداف ، فرضیات و سئوالات تحقیق
اهداف تحقیق
فرضیات تحقیق
سئوالات تحقیق
روش تحقیق و پژوهش
فصل دوم : کلیات تحقیق
فلزات سنگین
منشاء فلزات سنگین
سابقه تحقیقات در مورد سرب
سابقه تحقیقات در مورد سرب و اثر آلوده کنندگی آن در انسان
اثر آلوده کنندگی سرب در آب دریا و ماهیان
سابقه تحقیقات در مورد آهن
سابقه تحقیقات راجع به مسمومیت با آهن و اثر آلوده کنندگی آن بر انسان
اثر آلوده کنندگی آهن در آب دریا و ماهیان
مقادیر استاندارد پیشنهاد شده آهن و سرب از سوی سازمانها و محققان مختلف
فصل سوم : مواد و روش کار
مواد و لوازم مورد نیاز
روش کار
تاریخچه دستگاه جذب اتمی
قسمتهای مختلف دستگاه جذب اتمی
روش کار با دستگاه جذب اتمی با شعله
آماده سازی نمونه ها جهت اندازه گیری فلزات
عمل هضم اولیه در فلزات
فصل چهارم : نتایج تحقیق
فصل پنجم : بحث و پیشنهادها
منابع
فهرست جدول ها
جدول ۴-۱ میانگین و انحراف معیار آهن و سرب در کل نمونههای خوراک
جدول ۴-۲ میانگین و انحراف معیار آهن و سرب خوراک تولید شده در کارخانههای مختلف
جدول ۴-۳ میانگین و انحراف معیار آهن و سرب در کل نمونههای ماهی
جدول ۴-۴ میانگین و انحراف معیار آهن و سرب ماهیان تغذیه شده از خوراک کارخانههای مختلف
جدول ۴-۵ میانگین و انحراف معیار آهن و سرب در کل نمونههای آب مزارع مورد نمونهبرداری
جدول ۴-۶ -میانگین و انحراف معیار آهن و سرب آب تامین کننده مزارع مختلف
فهرست نمودارها
نمودار ۴-۱ میزان آهن در آب ورودی مزارع مختلف
نمودار ۴-۲ میزان آهن در ماهیان تغذیه شده با خوراک کارخانجات مختلف
نمودار ۴-۳ میزان آهن موجود در خوراک کارخانجات مختلف
نمودار ۴-۴ میزان سرب موجود در خوراک کارخانجات مختلف
نمودار ۴-۵ میزان سرب در آب ورودی مزارع مختلف
نمودار ۴-۶ میزان سرب در ماهیان تغذیه شده با خوراک کارخانجات مختلف
فهرست شکلها
شکل ۳-۱ قسمتهای مختلف دستگاه جذب اتمی (سیستم تک پرتویی)
دانلود در ادامه مطلب
هدف از آزمايش: آشنايي با تهيه دي بنزال استون
مواد لازم: آب، سديم هيدروكسيد ، اتانول، استون ، اتيل استات بنزالدهي.
وسايل لازم: ارلن ماير،استوانه مدرج، بشر ،قیف بوخنر ،كاغذ صافي.
تئوری:
اگر مخلوط آلدئیدها و یا کتونهای متفاوت و یا هر دوی آنها در محیط حضور داشته باشند، منجر به تولید محصولات تراکمی متنوع میشود. در مورد کتونهای دارای دو گروه متیلن یا در حالت خاص دو گروه متیل مثل استون اگر نسبت مولی بنزآلدئید به استون به صورت 2 به 1 باشد دی بنزال استون به جای بنزال استون تشکیل میشود.
روش كار:
4گرم سديم را با 20 ميلي ليتر آب در يك ارلن ماير 250 ميلي ليتر ریختیم و تكان دادیم تا حل شود.در مرحله ی بعد 20 ميلي ليتر اتانول به مخلوط اضافه كردیم و سپس صبر کردیم تا کمی سرد شود.( بعد از اضافه کردن اتانول و قبل از اضافه کردن استون و بنزآلدهید برای جلوگیری از واکنشهای جانبی و کانیزار باید اجازه داد تا دمای ظرف به دمای اتاق(آزمایشگاه) برسد) .در یک استوانه ی مدرج 6cc بنز الدئید وgr 3 استون را با هم مخلوط کردیم.نیمی از محلول استوانه مدرج را به ارلن اضافه کردیم و به مدت 5 دقیقه به هم زدیم . رنگ محلول به سرعت به زرد تا نارنجي تغيير کرد (رنگ به خلوص بنزالدهيد بستگي دارد) سپس نیمی دیگر از محلول را که در استوانه ی مدرج باقی مانده بود به ارلن اضافه کردیم واین بار 15 دقیقه به هم زدیم
(مخلوط گرم ميشود و تقريبا بي درنگ رسوب زرد رنگ حاصل ميشود).سپس مخلوط را روي قيف بوخنر صاف كردیم محصول را با كمي الكل سرد شستیم و اجازه دادیم تا خشك شود سپس رسوب خشک شده را توزین کردیم و راندمان آنرا مطابق مراحل زیر به دست آوردیم
محاسبات :
6 ÷ 106.13 = 0.056
3 ÷ 58.08 = 0.051 (محدود کننده)
محدود کننده / جرم مولی = X / جرم مولی دی بنزال استون (محصول)
در نتیجه :
0.051 / 58.08 = X / 248 0.217 (مقدار نظری)
راندمان = مقدار عملی / مقدار نظری × 100
در نتیجه :
وزن رسوب / 0.217 × 100 = ؟
خطای آزمایش :
بعد از اضافه کردن اتانول و قبل از اضافه کردن استون و بنزآلدهید برای جلوگیری از واکنشهای جانبی و کانیزار اجازه دهید تا دمای ظرف به دمای اتاق(آزمایشگاه) برسد.
نتیجه گیری:
در این آزمایش از بنزآلدهید به عنوان الکترون دوست و از استون به عنوان هسته دوست استفاده می شود
تعيين غلظت سولفات آهن به روش منگانومتري در ادامه مطلب
گزارش کار های شیمی فیزیک در ادامه مطلب
برای دانلود پاورپوینت معرفی و روش های تولید نانوکامپوزیت های پلیمری ببه ادامه مطلب بروید

دانلود پروژه تماس غشایی در چهار فصل در ادامه مطلب
دانلود مقاله و جزوه شناخت آبهای صنعتی و روشهای تصفیه آن در ادامه مطلب
نمودار دما- آنتروپي براي هوا در ادامه مطلب
دانلود گزارش کار آزمایشگاه کنترل فرآیند مهندسی شیمی با موضوعات زیر در ادامه مطلب
کنترل فشار - دبی - سطح - دما
همراه با تصاویر دستگاه ها و توضیحات کامل
دانلود پاورپوینت در رابطه با روتاری ولو Rotary valve در ادامه مطلب
دانلود گزارشکار آزمایشگاه انتقال حرارت با موضوعات زیر در ادامه مطلب
گزارشکار آزمایشگاه انتقال حرارت
انتقال حرارت تابشی
انتقال حرارت جابه جایی
انتقال حرارت هدایت
اندازه گیری صنعتی دما
سطوح گسترش يافته
ضریب هدایت حرارتی صفحات پلیمری
مبدل حرارتیShell & Tube
مبدل لوله ای


حذف فلزات سنگین از فاضلاب هاي صنعتی در ادامه مطلب
جهت مشاهده مطلب قبلی تعادل اینجا کلیک کنید.

کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
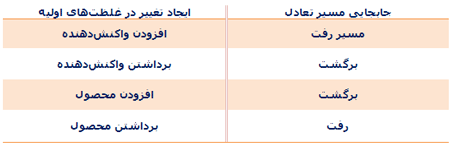
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم تغییرات زیر را در سیستم واکنش ایجاد کنیم:

در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم را تحت تأثیر قرار دهد.
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی به طور مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛ بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه کنید:
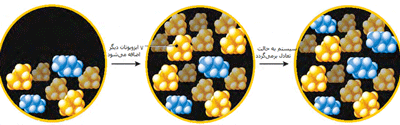
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است. با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
در واکنش زیر، افزودن BaCl2 باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد شد تا وضعیت تعادلی جدید برقرار شود:
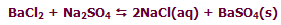
در واکنش زیر افزودن Cl2 به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی سیستم در جهت برگشت خواهد شد:
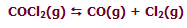
به نظر شما با این افزایش Cl2 چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
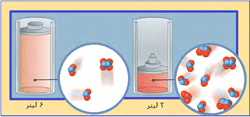
در شکل بالا، گاز N2O4 با NO2 در حال تعادل است:
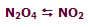
ابتدا نسبت N2O4 به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N2O4 به NO2 اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابراین یک واکنش گرماده است.
|
گرما، محصول دیگر این واکنش است: |
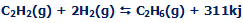 |
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
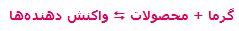
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید کند).
به مثال زیر توجه کنید:
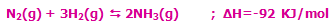
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!

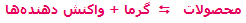
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی بیش تر). به مثال زیر توجه کنید:
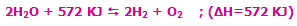
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود تا اکسیژن و هیدروژن بیشتری تولید کند.
برای مشاهده مطلب قبلی تعادل اینجا کلیک کنید

تغییرات آهنگ واکنش در هنگام نزدیک شدن واکنش به حالت تعادل:
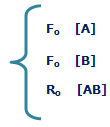
به شکل زیر توجه کنید؛ در لحظهی t=0 مقدار زیادی از مولکولهای A و B وجود دارد (در t=0 محصول AB تشکیل نشده است) و واکنش رفت سریع است (آهنگ واکنش رفت با Fo نشان داده میشود) و واکنش برگشت اتفاق نیفتاده است (آهنگ واکنش برگشت با Ro نشان داده میشود).
با گذشت زمان، AB تشکیل میشود و A و B مصرف میشوند، بنابراین طبیعی است که آهنگ رفت و برگشت تغییر کند. هر چه زمان میگذرد، واکنش رفت کندتر شده (A و B کمتری باقی مانده) و واکنش برگشت سرعت میگیرد (مولکولهای AB بیشتری تولید شده است).
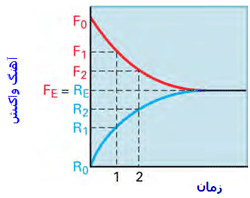
آهنگ واکنش:
در حالت تعادل، آهنگ واکنش رفت و برگشت دقیقاً با هم مساوی خواهند بود:
 |
 |
 |
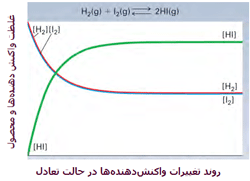
به عنوان یک مثال از بحث قبلی، واکنش گاز هیدروژن با گاز ید را در نظر میگیریم:
این دو گاز برای تشکیل یدید هیدروژن (HI) با هم وارد واکنش میشوند. هنگامی که سیستم به تعادل میرسد، آهنگ واکنش رفت و برگشت کاملاً با هم برابر میشوند و غلظت نسبی HI، H2 و I2 ثابت باقی میماند. در حالت تعادل، مقدار HI از H2 و I2 بیشتر است. در شکل زیر، روند این واکنش را مشاهده میکنید.
منظور از [HI] غلظت مولکولهای HI در واکنش است.
در واکنش ید و هیدروژن و تشکیل یدید هیدروژن، مقادیر نسبی HI، I2 و H2 در سیستمهای تعادلی مختلف با ثابت تعادل واکنش تعریف میشود. این مقادیر در جدول زیر آمدهاند.
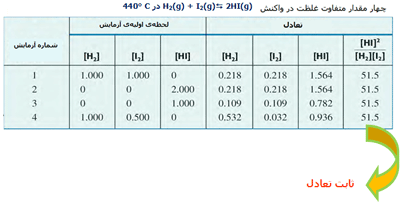
حال ببینیم چگونه میتوان ثابت تعادل را محاسبه کرد؟
برای هر واکنش شیمیایی در یک دمای معین، نسبت حاصلضرب غلظت اجزای سمت راست واکنش که هر کدام از آنها به توان ضریب خود (تعداد آن محصول) میرسد، به حاصلضرب غلظت اجزای سمت راست واکنش که آنها نیز به توان ضریب خود میرسند، مقدار ثابتی دارد که به آن ثابت تعادل (K) گفته میشود.
در واکنش زیر، محاسبهی ثابت تعادل با استفاده از روش ذکر شده بدین صورت خواهد بود:
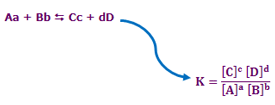
K ثابت تعادل واکنش بوده و مستقل از دما و نوع واکنش است.
به عنوان مثال محاسبهی ثابت تعادل واکنش، معادلهی زیر را در نظر میگیریم:
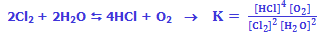
مواد واکنش دهندهی جامد و مایع در اکثر واکنشهای شیمیایی، غلظتهای ثابتی دارند و در محاسبهی K از آنها صرفنظر میشود:
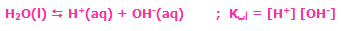
مقدار ثابت تعادل اطلاعات جالبی راجع به غلظت مواد درگیر واکنش و مورد توجه بودن واکنش رفت یا برگشت به ما می دهد؛ به عنوان مثال وقتی می گوییم مقدار K یک واکنش 1 * 109 است، یعنی غلظت محصولات به طور چشم گیری بیش تر از غلظت واکنشدهنده هاست ( 109 * 1 برابر غلظت واکنش دهنده ها است). برای نمکهایی که به سختی در آب حل می شوند، KSP تعریف می شود که ثابت حاصلضرب انحلال پذیری نام دارد.
مقدار K هر چه که باشد، میتوان آنرا اینگونه تفسیر کرد:

وقتی [ محصولات ] > [ واکنشدهندهها ] و K بزرگ است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت رفت پیشرفت کرده است.

وقتی [ واکنشدهندهها ] > [ محصولات ] و K کوچک است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت برگشت پیشرفت کرده است.

وقتی K از 0.1 تا 10 تغییر میکند و [ محصولات ] تقریبا مساوی با [ واکنشدهندهها ]:
- مقادیر قابل توجه و محسوسی از هر دو موجود است.
در تمام موارد بالا، سیستم در حالت تعادل قرار دارد.
جهت دیدن مطلب قبلی درباره تعادل اینجا کلیک کنید.
در مطلب قبل به شرایط تعادل و انجام واکنشهای شیمیایی اشاره شد. حال ببینیم فراهم شدن شرایط واکنش، گویای کدام خاصیت فیزیکی مواد است و چه عواملی، انجام سریعتر و بهینهتر واکنشهای مواد را تحت تأثیر قرار میدهند؟
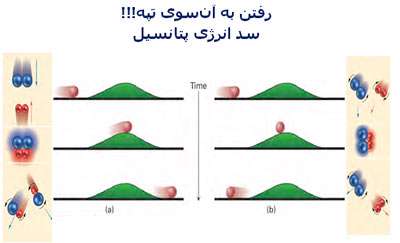
در شکل بالا به خوبی دیده میشود که برای این که واکنشی صورت پذیرد، شرایط لازم برای آن (تعداد و جهت مناسب ذرات واکنش دهنده و انرژی جنبشی کافی آن ها) چگونه تشکیل محصولات را تحت تأثیر قرار می دهد.
در حالت (a) سیستم، انرژی کافی برای رفتن به آن سوی تپه و غلبه به سد انرژی پتانسیل را دارد؛ بنابراین محصولات تشکیل میشوند.
در حالت (b) سیستم، انرژی کافی برای عبور از سد انرژی پتانسیل ندارد؛ بنابراین محصولات این برخورد ناموفق تشکیل نمیشوند.
در مطلب قبلی گفته شد که انرژی فعالسازی، حداقل انرژی لازم برای ایجاد انرژی برخورد مؤثر است تا واکنش انجام شود. با مقایسهی این مطلب و شکل قبل میبینیم که اگر شرایط انجام واکنش مهیا باشد و انرژی فعالسازی نیز کافی باشد، میتوان به سد پتانسیل غلبه کرد. به نظر شما این سد پتانسیل ناشی از چیست؟
حال ببینیم چه عواملی بر سرعت و کارایی واکنش های شیمیایی تأثیر دارند:
· دمای واکنش: با افزایش دما سرعت انجام واکنش نیز بالا می رود.
· کاتالیزگرها: کاتالیست مناسب، سرعت واکنش را بالا می برد.
· غلظت واکنش دهنده ها: غلظت زیاد واکنش دهنده ها موجب سرعت یافتن واکنش می شود.
اثر دما بر آهنگ واکنش:
در فرایند تبخیر مولکول های آب در یک ظرف در بستهی نیمه پر، مولکول ها در فضای گازی بالای آب در حال تبخیر، توزیعی از سرعت های مختلف دارند؛ برخی از این مولکول ها کند و برخی بسیار سریع حرکت می کنند.
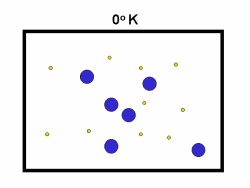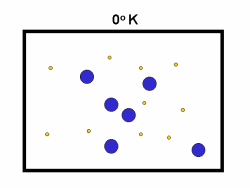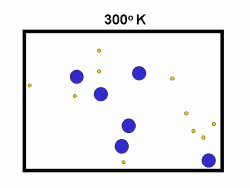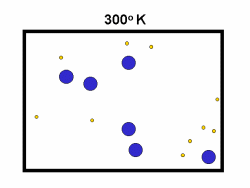
شکل بالا این مطلب را به خوبی نشان میدهد؛ دایرههای آبی، مولکولهاییاند که سرعت حرکت بالایی دارند و دایرههای قرمز، مولکول هاییاند که سرعت کمی دارند. حال ببینیم تغییر دما چه تأثیری بر روی سرعت مولکول ها دارد؟
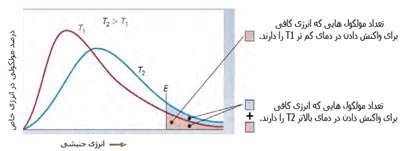
· تنها کسری از مولکولهای نشان داده شده در ناحیهی پایینی منحنی در سمت راست، انرژی جنبشی کافی برای واکنش دادن دارند.
· کسر بزرگی از مولکولها میتوانند در دماهای بالاتر واکنش دهند.
در زندگی روزمره نیز واکنشهای شیمیایی فراوانی را در همین ارتباط مشاهده میکنیم؛ به عنوان مثال، آهنگ فاسد شدن غذای منجمد شده نسبت به غذایی که در دمای عادی نگهداری میشود، کمتر است. همچنین، غذا در زودپز خیلی سریعتر از حالت عادی پختن غذا میپزد زیرا در دمای بالاتری به جوش میآید اما همین غذا اگر در منطقهای که ارتفاع بالایی نسبت به سطح دریا دارد پخته شود، دیر خواهد پخت؛ زیرا فشار پایینتر، نقطهی جوش را پایینتر میآورد.
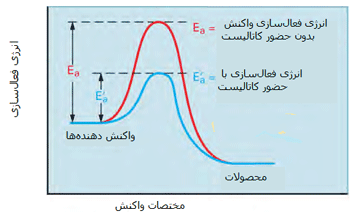
نقش کاتالیزورها در آهنگ واکنش:
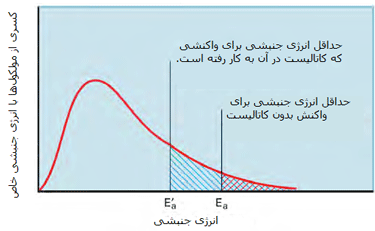
مطابق شکل زیر، یک کاتالیست راهی را فراهم میکند که واکنش با انرژی فعالسازی کمتری اتفاق بیفتد؛ بنابراین بیشتر مولکولهایی که انرژی جنبشی کمتری دارند، قادر خواهند بود از سد انرژی پتانسیل عبور کنند.
در شکل دوم، کسری از مولکولها با انرژی کافی برای وارد شدن به برخوردهایی که باعث انجام واکنش میشوند، در صورت وجود کاتالیست افزایش پیدا میکند زیرا سد انرژی فعالسازی پایین میآید.
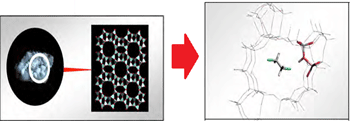
حال مثالی از نقش کاتالیست زئولیت (نوعی سیلیکات آبدار) در انجام واکنش میآوریم تا این مطلب را به خوبی درک کنید:
زئولیتها جامدهایی با شبکهی کوالانسیاند و دارای حفرهها و کانالهایی خاص هستند و مولکولهای گازی میتوانند از طریق این کانالها پخش شوند. زمانی که دو مولکول گاز درون زئولیت با همدیگر روبهرو میشوند، مجبور به نزدیک شدن به هم در یک جهت ویژه میشوند (این جهت ویژه، جهتگیری درست برای انجام واکنش است). این دو مولکول مدت طولانی را با هم میمانند و شانس بیشتری برای واکنش دارند. طبیعت کاتالیستها این است که به طور مستقیم در واکنش شرکت میکنند (اما واکنشدهنده یا محصول نیستند) و محیط مناسبی برای انجام واکنش فراهم کرده و سد انرژی فعالسازی را پایین میآورند.
 |
تأثیر غلظت بر سرعت واکنش:
آهنگ یک واکنش به تعداد برخوردها در واحد زمان نیز بستگی دارد. هرچه تعداد ذرات موجود در حجم خاص که واکنش در آن صورت میگیرد زیاد باشد، برخوردهای متوالی بیشتری اتفاق خواهد افتاد و واکنشها با سرعت بیشتری انجام خواهند گرفت. به شکل زیر که سوختن برادهی فولاد در اکسیژن را نشان میدهد، توجه کنید:

در ردیف اول، برادهی فولاد در هوا (غلظت کم اکسیژن) حرارت داده میشود. در ردیف دوم، برادهی فولاد در اکسیژن خاص حرارت داده میشود. این مشاهده براساس توجیهات بالا کاملاً قابل درک است.

· تعادل چیست؟
· چگونه به سرعت میتوان به تعادل در یک واکنش شیمیایی رسید؟
· آیا دما روی تعادل و آهنگ واکنش تأثیر دارد؟
· ثابت تعادل چیست؟
· آیا تعادل روی مقدار محصولات واکنش (بازده) تأثیر دارد؟
در این مجموعه به تمامی سؤالات بالا پاسخ خواهیم داد. اما به راستی تعادل چیست؟ تعادل شیمیایی و تعادل فیزیکی چگونه حاصل میشوند؟
زمانی که یک واکنش شیمیایی شروع میشود، ابتدا واکنش دهندهها وارد عمل میشوند. رفته رفته از غلظت واکنش دهندهها کم شده و به غلظت محصولات اضافه میشود. در نهایت، زمانی میرسد که هیچ تغییری در غلظت واکنش دهندهها و محصولات مشاهده نمیشود. چنین واکنشهایی که در آنها فقط قسمتی از مقدار کلی واکنش دهندهها به محصول تبدیل میشود، فرایندهای برگشتپذیر نامیده میشوند.
تعادل زمانی است که:
تعادل فیزیکی شامل تغییرات خواص شیمیایی مواد مرتبط با واکنش نیست. برای نمونه، تعادل بخار آب با خود آب در یک بطری در بستهی نیمه پر یک تعادل فیزیکی است زیرا مولکولهای آب فقط از مایع به بخار تبدیل میشوند.
تعادل شیمیایی با تغییر در ترکیب شیمیایی مواد، شکستن و تشکیل پیوند مرتبط است. یک مثال برای این تغییر، تجزیهی اسید استیک است. مبادلهی ذرات بین یونها و مولکولها در این تجزیه وجود دارد؛ زمانی که تعادل حاصل میشود، آهنگ مبادلهی ذرات بین یونها و مولکولها مساوی میشود.
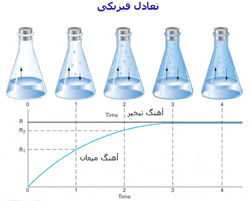
مثال 1 از تعادل فیزیکی : تا مرحلهی 3، آهنگ تبخیر و آهنگ میعان کاملاً با هم متفاوتند و عمل تبخیر، بیشتر صورت میگیرد اما با گذشت زمان، میعان هم رو به افزایش است. در مرحلهی 3 و 4 آهنگ تبخیر و آهنگ میعان برای هر تغییر فیزیکی برابرند.
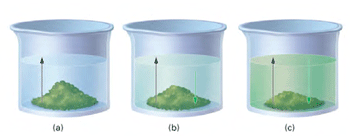 |
در حالت (c) آهنگ رفت (حل شدن مادهی جامد در حلال) و آهنگ برگشت (بلوری شدن مادهی حل شونده) در تعادل فیزیکیاند.

سؤال: در یک سیستم تعادلی، چه چیزهایی مساوی یا متعادل هستند؟

آهنگ واکنش
با استفاده از نظریهی برخورد در واکنشهای شیمیایی میتوان این مطلب را درک کرد. یک تغییر شیمیایی که به طور ماکروسکوپی قابل مشاهده است، نتیجهی تعداد زیادی از برخوردها مابین ذرات واکنش دهنده است. در شکل زیر و در حالت a، مولکولهای آبی و قرمز به دلیل اینکه انرژی جنبشی کافی و جهت مناسب دارند، واکنش انجام میگیرد. در حالت b با اینکه مولکولها جهت مناسب دارند ولی انرژی جنبشی کافی ندارند، واکنش انجام نمیگیرد. در حالت c مولکولها در برخورد با هم انرژی جنبشی کافی دارند اما جهتگیری آنها مناسب نیست؛ پس در این حالت نیز واکنش انجام نمیگیرد.
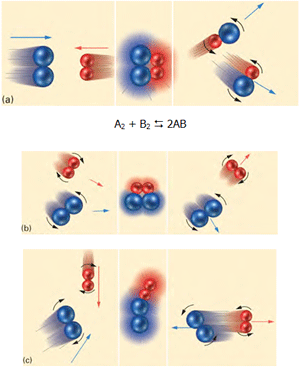
حال ببینیم تغییرات انرژی در طول واکنش به چه صورت است:
انرژی لازم برای واکنش (ΔE ) است. برای تشکیل محصولات، بایستی کمپلکسی از مجموعه ذرات فعال در واکنش با انرژی بالا نیز تشکیل شود. کمپلکس فعال شده، نوعی حالت واسطهی مولکولی است که در حین برهمکنش (برخورد) مولکولهای در حال واکنش با یک تغییر شیمیایی تشکیل میشود؛ بالاترین مقدار انرژی در حین واکنش به این حالت اختصاص دارد.
انرژی فعال سازی (Ea) کمترین انرژی جنبشی لازم برای تولید انرژی برخورد مؤثر است و با این انرژی میتوان به بالای تپه رفت!!!